Dung dịch NaOH nồng độ 10% có khối lượng riêng là 1.109 g/ml
a, Hãy trình bày cách điều chế 5 lít dung dịch NaOHnồng độ 10%
b, Hãy trình bày nộng độ mol của dung dịch đó
Mọi người giúp mình với ạ![]()
Hãy trình bày cách pha chế 0,5 lít dung dịch NaOH 10% có khối lượng riêng là 1,109g/ml
1) Gọi thể tích các dung dịch NaOH có nồng độ 3% và 10% cần dùng lần lượt là V_1 và V_2.
m_NaOH 3%= 1,05(V_1)3%= 0,0315V_1.
m_NaOH 10% =1,12(V_2)10%= 0,112V_2.
m_NaOH 8%= 1,1.2000.8% =176.
Theo đề bài ta có hệ phương trình:
0,0315V_1 + 0,112V_2= 176 ∩ V_1+ V_2 =2000 => V_1= 96000/161 (mℓ), V_2= 226000/161 (mℓ).
- Tính toán:
Ta có: \(D=\dfrac{m_{dd_{NaOH}}}{0,5}=1,109\left(\dfrac{g}{ml}\right)\)
\(\Rightarrow m_{dd_{NaOH}}=0,5545\left(g\right)\)
Ta lại có: \(C_{\%_{NaOH}}=\dfrac{m_{NaOH}}{0,5545}.100\%=10\%\)
\(\Rightarrow m_{NaOH}=0,05545\left(g\right)\)
\(\Rightarrow m_{H_2O}=0,5545-0,05545=0,49905\left(g\right)\)
- Cách pha:
+ Chọn bình có thể tích trên 0,5 lít.
+ Cho 0,49905 gam nước vào bình.
+ Sau đó cho 0,05545 gam NaOH vào, khuấy đều là được dung dịch NaOH 10%.
Hãy tính toán và trình bày cách pha chế 0,5lit dung dịch H 2 S O 4 có nồng độ 1mol/l từ H 2 S O 4 có nồng độ 98%, khối lượng riêng là 1,84g/ml.
* Số mol của H 2 S O 4 cần để pha chế 500ml dung dịch H 2 S O 4 1M:
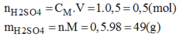
* Khối lượng H 2 S O 4 98% có chứa 49g H 2 S O 4 :
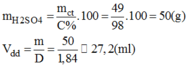
* Cách pha chế: Đổ khoảng 400ml nước cất vào cốc có chia độ có dung tích khoảng 1lit. Rót từ từ 27,2ml H 2 S O 4 98% vào cốc khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500ml. ta pha chế được 500ml dung dịch H 2 S O 4 1M.
Ai giúp em với a/ Tìm khối lượng nước, đường có trong 120g dung dịch nước đường có nồng độ 5% b/ Trình bày cách pha chế 200g dung dịch nước đường có nồng độ 10%
a) Khối lượng đường là
120 . 5% = 6g
Khối lượng nước là :
120 - 6 = 114g
b) Cách pha chế
Cần số gam đường là : 200.10% = 20g
Số gam nước là : 200 - 20 = 180g
Vậy cần 20g đường và 180g nước để pha chế
a)
\(m_{đường} = 120.5\% = 6(gam)\\m_{nước} = m_{dung\ dịch} - m_{đường} = 120 -6 = 114(gam)\)
b)
\(m_{đường} =200.10\% = 20(gam)\\ m_{nước} = 200 -20 = 180(gam)\)
Pha chế :
Cân lấy 20 gam đường cho vào cốc dung tích khoảng 3 lít
Đong lấy 180 gam nước cho vào cốc, khuấy đều.
Hãy trình bày cách pha chế các dung dịch theo những yêu cầu sau:
200g dung dịch có nồng độ 10% của mỗi chất nói trên.
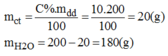
* NaCl: Cân lấy 20g NaCl cho vào bình tam giác. Cân lấy 180g nước cất rồi đổ dần dần vào cốc và khuấy nhẹ cho NaCl tan hết. Được 200g dung dịch NaCl 10%.
* K N O 3 : Cân lấy 20g K N O 3 ch vào bình tam giác. Cân lấy 180g nước cất rồi đổ vào bình. Lắc mạnh cho H N O 3 tan hết, ta dược 200g dung dịch K N O 3 10%.
* C u S O 4 ; Cân lấy 20g C u S O 4 cho vào bình tam giác. Cân lây 180g nước cất rồi đổi vào bình. Lắc mạnh cho C u S O 4 tan hết ta được 200g dung dịch C u S O 4 10%.
Bia được sản xuất bằng cách lên men dung dịch mantozo (C12H22O11, sản phẩm tạo thành làrượu etylic và khí CO2 với tỉ lệ mol 1:1. Cho lên men 50 lít dung dịch mantozo có khối lượng riêng 1,052 g/ml, chứa 8,45% khối lượng mantozo, biết khối lượng riêng của rượu etylic là 0,8g/ml; hiệu suất quá trình lên men là 65%. Hãy:
a) Viết phương trình hóa học và tính khối lượng rượu etylic được tạo thành từ quá trình lên men 50 lít dung dịch mantozo.
b) Từ lượng rượu etylic thu được ở trên có thể pha chế được bao nhiêu lít bia có độ rượu là 5,50?
Trộn 150ml dung dịch HCl 10% có khối lượng riêng D=1,206 g/ml với 250 ml dung dịch HCl 2M thu được dung dịch A . Tính nồng độ mol của dung dịch A
\(m_{dd_{HCl\left(10\%\right)}}=150\cdot1.206=180.9\left(g\right)\)
\(n_{HCl}=\dfrac{180.9\cdot10\%}{36.5}\approx0.5\left(mol\right)\)
\(n_{HCl\left(2M\right)}=0.25\cdot2=0.5\left(mol\right)\)
\(n_{HCl}=0.5+0.5=1\left(mol\right)\)
\(V_{dd_{HCl}}=150+250=400\left(ml\right)=0.4\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{1}{0.4}=2.5\left(M\right)\)
Cho 7 gam Fe vào 160 ml dung dịch CuSO4 28% có khối lượng riêng (D = 1,25(g/cm3). Hãy: a. Viết phương trình hóa học
b. Xác định nồng độ dung dịch thu được sau phản ứng.( V dd coi như không đổi)
ai giải giúp mình với ạ
a)
$Fe + CuSO_4 \to FeSO_4 + Cu$
b) $n_{Fe} = \dfrac{7}{56} = 0,125(mol) ; n_{CuSO_4} = \dfrac{160.1,25.28\%}{160} = 0,35(mol)$
Ta thấy : $n_{Fe} < n_{CuSO_4}$ nên $CuSO_4$ dư
Theo PTHH : $n_{FeSO_4} = n_{CuSO_4\ pư} = n_{Fe} = 0,125(mol)$
$n_{CuSO_4\ dư} = 0,35 - 0,125 = 0,225(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,125}{0,16} = 0,78125M$
$C_{M_{CuSO_4}} = \dfrac{0,225}{0,16} = 1,40625M$
Có 2 lọ đựng dung dịch H 2 S O 4 . Lọ thứ nhất có nồng độ 1mol/l, lọ thứ hai có nồng độ 3 mol/l. Hãy tính toán và trình bày cách pha chế 50ml dung dịch H 2 S O 4 có nồng độ 1,5mol/l từ 2 dung dịch axit đã cho.
Pha chế 50ml dung dịch H 2 S O 4 1,5M.
- Số mol H 2 S O 4 cần pha chế 50ml dung dịch H 2 S O 4 1,5M:
n H 2 S O 4 = CM.V = 1,5.0,05 = 0,075 (mol)
Gọi x(ml) là thể tích của dung dịch H 2 S O 4 1M (1)
Gọi y(ml) là thể tích của dung dịch H 2 S O 4 3M (2)
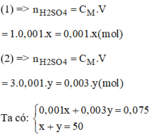
Giải hệ phương trình ta có: x = 37,5ml; y = 12,5ml
- Cách pha chế:
+ Đong lấy 37,5ml dung dịch H 2 S O 4 1M và 12,5ml dung dịch H 2 S O 4 3M cho vào bình, lắc đều, ta được 50ml dung dịch H 2 S O 4 1,5M.
cho 1,96g bột sắt vào 100ml dung dịch CuSO4 10% có khối lượng riêng là 1,12 g/ml
a, viết PTHH
b, Xác định nồng độ mol của chất trong dung dịch khi phản ứng kết thúc. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể
giúp mình với ạaa
a, \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
b, \(n_{Fe}=\dfrac{1,96}{56}=0,035\left(mol\right)\)
\(m_{ddCuSO_4}=100.1,12=112\left(g\right)\)
\(\Rightarrow n_{CuSO_4}=\dfrac{112.10\%}{160}=0,07\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,035}{1}< \dfrac{0,07}{1}\), ta được CuSO4 dư.
Theo PT: \(n_{CuSO_4\left(pư\right)}=n_{FeSO_4}=n_{Cu}=n_{Fe}=0,035\left(mol\right)\)
\(\Rightarrow n_{CuSO_4\left(dư\right)}=0,07-0,035=0,035\left(mol\right)\)
Ta có: m dd sau pư = 1,96 + 112 - 0,035.64 = 111,72 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{0,035.152}{111,72}.100\%\approx4,76\%\\C\%_{CuSO_4}=\dfrac{0,035.160}{111,72}.100\%\approx5,01\%\end{matrix}\right.\)